Κανάτα Ελένη Α’2
|
Υπεύθυνη καθηγήτρια: Μητσοπούλου Αθηνά
|
Μέταλλα - Αμέταλλα-Μεταλλοειδή
|
|||||||||||||||||
Εργασία στη Χημεία
Περιεχόμενα
Εισαγωγή
Γενικά, η
προσπάθεια κατανόησης των χημικών
ιδιοτήτων αρχίζει με την ταξινόμηση των στοιχείων. Μία από τις προφανείς και χρήσιμες διακρίσεις είναι η ταξινόμηση των στοιχείων σε μέταλλα και αμέταλλα και γίνεται με βάση τις φυσικές και τις χημικές τους ιδιότητες. Ο διαχωρισμός αυτός δεν είναι απόλυτος. Μερικά στοιχεία έχουν ιδιότητες οι οποίες είναι ενδιάμεσες των ιδιοτήτων των μετάλλων και των αμετάλλων. Τα στοιχεία αυτά λέγονται μεταλλοειδή ή ημιμέταλλα.
Η έλξη που
ασκούν οι πυρήνες των διαφόρων
ατόμων σε ηλεκτρόνια των εξωτερικών φλοιών ή υποφλοιών χρησιμοποιείται σαν βάση για τη διάκριση των στοιχείων του περιοδικού συστήματος σε δύο τάξεις:
α) στα
στοιχεία που οι πυρήνες τους ασκούν μικρή
έλξη στα ηλεκτρόνια των εξωτερικών φλοιών και υποφλοιών. Τα στοιχεία αυτά χαρακτηρίζονται σαν μέταλλα.
β) στα
στοιχεία που οι πυρήνες τους ασκούν μεγάλη
έλξη στα ηλεκτρόνια των εξωτερικών φλοιών και υποφλοιών. Τα στοιχεία αυτά χαρακτηρίζονται ως αμέταλλα.
Τυπικά
παραδείγματα μετάλλων είναι το
νάτριο (Na), το λίθιο (Li), το τιτάνιο(Ti) και ο ψευδάργυρος (Zn), ενώ τυπικά παραδείγματα αμετάλλων είναι το οξυγόνο (Ο), το βρόμιο (Βr) και το θείο (S). Παράδειγμα μεταλλοειδών είναι το πυρίτιο (Si) και το γερμάνιο (Ge). 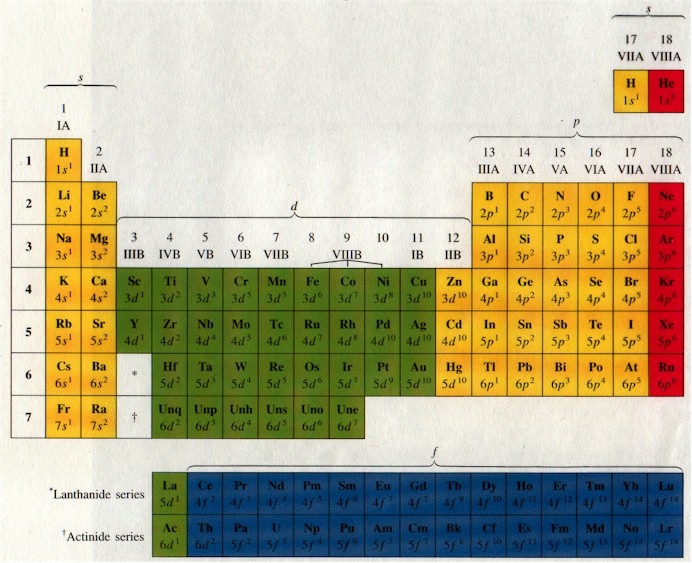 Μέταλλα
Περισσότερα
από 30 μέταλλα έχουν βρεθεί
σε ελεύθερη κατάσταση στο στερεό φλοιό της γης. Αλλά η κυριότερη πηγή προέλευσης των περισσότερων μετάλλων είναι οι διάφορε ενώσεις τους. Οι πιο βασικές φυσικής προέλευσης ενώσεις των μετάλλων είναι κατ’ αρχήν τα οξείδια και τα οξυγονούχα άλατά τους.
Τα μέταλλα
βρίσκονται στις τρεις πρώτες κύριες ομάδες,
στις τελευταίες θέσεις των υπολοίπων κυρίων ομάδων και σε όλες τις δευτερεύουσες ομάδες του περιοδικού συστήματος. Τα μέταλλα καταλαμβάνουν περισσότερο από τα 2/3 του περιοδικού πίνακα. Αυτά κατατάσσονται σε δύο μεγάλες οικογένειες , τα απλά μέταλλα και τα μέταλλα μετάπτωσης (ή βαρέα μέταλλα). Στα απλά μέταλλα ανήκουν ορισμένες χαρακτηριστικές ομάδες στοιχείων, όπως είναι τα αλκάλια και οι αλκαλικές γαίες (ομάδες IA και IIA αντίστοιχα). Οι δύο αυτές ομάδες των απλών μετάλλων μαζί με ορισμένα άλλα απλά μέταλλα, όπως π.χ. το αργίλιο, αποτελούν τα λεγόμενα κανονικά μέταλλα, τα άτομα των οποίων έχουν συμπληρωμένες τις εσωτερικές ηλεκτρονικές στοιβάδες τους. Σε αντίθεση με τα μέταλλα μετάπτωσης και τε ευγενή μέταλλα (π.χ. χαλκός, άργυρος, χρυσός), στα κανονικά μέταλλα, τα ηλεκτρόνια σθένους των ατόμων τους χαρακτηρίζονται από ενέργειες που διαφέρουν σημαντικά από τις νέργειες των υπολοίπων ηλεκτρονίων των ατόμων τα οποία υφίστανται και στα αντίστοιχα ιόντα τους.
Τα μέταλλα,
όπως προαναφέρθηκε, δείχνουν μικρή έλξη στα
ηλεκτρόνια των εξωτερικών υποφλοιών και επομένως έχουν μικρή ηλεκτροσυγγένεια, μικρή ηλεκτραρνητικότητα και μικρή ενέργεια ιοντισμού. Τα μεγέθη αυτά αυξάνουν από αριστερά προς τα δεξιά, και ελαττώνονται από τα πάνω προς τα κάτω στην ίδια ομάδα του περιοδικού συστήματος.
Επειδή έχουν
μικρή ενέργεια ιοντισμού, μπορούν να δώσουν
κατά τις χημικές αντιδράσεις ένα, δύο ή σε ορισμένες περιπτώσεις και τρία ηλεκτρόνια και να μετατραπούν σε θετικά ιόντα.
Τα μέταλλα δεν
τείνουν να σχηματίζουν ενώσεις μεταξύ
τους
όσο τείνουν να συνδυάζονται με τα αμέταλλα, όπως το οξυγόνο και το θείο. Στην αλληλεπίδρασή τους με τα αμέταλλα σχηματίζουν ιοντικούς, ή αλλιώς ετεροπολικούς δεσμούς που χαρακτηρίζονται από ιδιότητες όπως τα υψηλά σημεία τήξης, τη διαλυτότητα στο νερό κ.ά.Κατά τη διάλυση μιας ιοντικής ένωσης στο νερό αυτή διίσταται στα ιόντα από τα οποία αποτελείται, λόγω εφυδάτωσής τους από τα μόρια του νερού. Το νερό έχει μεγάλη διηλεκτρική σταθερά οπότε οι δυνάμεις που αναπτύσσονται μεταξύ των μορίων του νερού και των αντιστοίχων ιόντων είναι σαφώς μεγαλύτερες από αυτές που συγκρατούν τα ιόντα στο κρυσταλλικό πλέγμα.Με τον τρόπο αυτό επιτυγχάνεται η διάσταση,δηλαδή η απελευθέρωση των ήδη προϋπαρχόντων ιόντων από τον ιοντικό κρύσταλλο.Κατά την εφαρμογή μιας διαφοράς δυναμικού τα ιόντα θα προσανατολιστούν στους πόλους (στο θετικό προσανατολίζονται τα ανιόντα και στον αρνητικό τα κατιόντα), οπότε τα ιόντα παίζουν πλέον το ρόλο των φορέων του ρεύματος. Αυτού του είδους η αγωγιμότητα λέγεται ιοντική αγωγιμότητα. Παρατηρείστε στο σχήμα που ακολουθεί το λαμπάκι που ανάβει γεγονός που πιστοποιεί την ύπαρξη ρεύματος. Με τη διαβίβαση του ρεύματος πραγματοποιείται και ηλεκτρόλυση του διαλύματος NaCl oπότε παράγεται μεταξύ άλλων και αέριο χλώριο, το οποίο φαίνεται από την πρασινοκίτρινη χροιά που αποκτά το διάλυμα.  Μεταλλικός δεσμός
Όπως φαίνεται
από την ηλεκτρονική δομή των ατόμων των
μετάλλων αυτά περιέχουν λίγα εξωτερικά ηλεκτρόνια (1-3e-). Στα κρυσταλλικά τους πλέγματα συγκρατιούνται με ιδιαίτερο τύπο δεσμού, το μεταλλικό δεσμό, στον οποίο οφείλουν και τις ιδιότητές τους.
Ο Drude (1900)
πρότεινε προκειμένου να καταστεί δυνατή η
ερμηνεία του μεταλλικού χαρακτήρα, να γίνει αποδεκτή η παραδοχή περί της παρουσίας ελευθέρων ηλεκτρονίων, τα οποία μετατοπίζονται ανάμεσα στα άτομα του μετάλλου. Τα ελεύθερα αυτά ηλεκτρόνια αποτελούν, επομένως, ένα ηλεκτρονιακό νέφος, το λεγόμενο «αέριο» ηλεκτρονίων, το οποίο διαχέεται ελεύθερα μέσα στο κρυσταλλικό πλέγμα, που αποτελείται από θετικά φορτισμένα μεταλλικά ιόντα (κατιόντα). Είναι δυνατόν να υποτεθεί ότι ένας κρύσταλλος μετάλλου αποτελεί ένα γιγαντιαίο μόριο και ότι τα ελεύθερα ηλεκτρόνια ανήκουν από κοινού στο σύνολο των ατόμων του μετάλλου που το συγκροτούν. Οι μεταλλικοί δεσμοί, στους οποίους οφείλεται η κατασκευή και σταθερότητα του μεταλλικού κρυστάλλου οφείλονται, στις ελκτικές δυνάμεις που ασκούνται μεταξύ των ελευθέρων ηλεκτρονίων και των μεταλλικών ιόντων. Μεταλλικοί κρύσταλλοι
Η
μελέτη της κρυσταλλικής δομής των μετάλλων δείχνει ότι
σε όλες σχεδόν τις περιπτώσεις τα άτομα είναι κατά τέτοιο τρόπο τοποθετημένα στο χώρο, ώστε το καθένα από αυτά να περιβάλλεται με το μεγαλύτερο δυνατό αριθμό άλλων ατόμων, με αποτέλεσμα το σύνολο των ατόμων να κατέχει τον μικρότερο δυνατό όγκο. Η διάταξη αυτή είναι γνωστή ως «δομή μέγιστης πυκνότητας» και οδηγεί σε περιορισμένο μόνο αριθμό γεωμετρικών διατάξεων και κατά συνέπεια κρυσταλλικών μορφών. Η δομή αυτή εξηγεί τις μεγάλες πυκνότητες των περισσοτέρων μετάλλων οι οποίες είναι πολύ μεγαλύτερες από αυτές που αντιστοιχούν και στα πυκνότερα αμέταλλα. Παρακάτω απεικονίζονται τα στοιχειώδη κύτταρα των μεταλλικών κρυσταλλικών πλεγμάτων, το χωροκεντρισμένο κυβικό, το ενδοκεντρωμένο κυβικό και το εξαγωνικό.  Φυσικές ιδιότητες
Οι φυσικές
ιδιότητες αποτελούν μία γενίκευση, καθώς τα διάφορα
στοιχεία έχουν σημαντικές διαφορές, κάποια στοιχεία μάλιστα παρουσιάζουν αντίθετες ιδιότητες. Σε γενικές γραμμές όμως ισχύουν τα παρακάτω.
Όλα τα μέταλλα
είναι στερεά εκτός από τον υδράργυρο που είναι υγρός
με σημείο τήξης τους -39⁰C. Σαν υγρά μπορεί να θεωρήσουμε και το φράγκιο (Fr), το καίσιο (Cs) και το γάλλιο (Ga), που έχουν αντίστοιχα σημείο τήξης τους 27⁰C, 28,7⁰C, 29,8⁰C. Ανάλογα με το σημείο τήξης τους τα μέταλλα διακρίνονται σε εύτηκτα, με σημείο τήξης < 500⁰C, δύστηκτα, με σημείο τήξης >500⁰C και πολύ δύστηκτα, με σημείο τήξης > 1400⁰C.
Τα μέταλλα
στην κατάσταση ατμών είναι μονοατομικά.
Με βάση την
πυκνότητά τους τα μέταλλα διακρίνονται σε ελαφριά, με d<5 g/cm3 ,
και βαριά με d>5 g/cm3.
Παρουσιάζουν
χαρακτηριστική μεταλλική λάμψη γιατί έχουν μεγάλη
αντανακλαστική ικανότητα. Εξαίρεση αποτελούν τα μέταλλα σε σπογγώδη κατάσταση ή σε πολύ λεπτό διαμερισμό, των οποίων η μεταλλική λάμψη χάνεται, επειδή το φως παγιδεύεται μέσα από τις πολυάριθμες μικρού μήκους ανακλάσεις στην ανώμαλη επιφάνειά τους. Η μεταλλική λάμψη αποδίδεται στην εύκολη απορρόφηση και επανεκπομπή φωτονίων από το «αέριο» των ελευθέρων ηλεκτρονίων που βρίσκονται στη επιφάνεια του μετάλλου. Τα περισσότερα μέταλλα ανακλούν όλα τα μήκη κύματος του ορατού φωτός, γι’ αυτό είναι αργυρόλευκα εκτός από το μαγγάνιο (Mn), που είναι σταχτί, τον χαλκό (Cu) που είναι κόκκινος, το βισμούθιο (Bi) που είναι ερυθρόλευκο και το χρυσό (Au) που είναι κίτρινος.
Τα μέταλλα
χαρακτηρίζονται από μεγάλη θερμική και ηλεκτρική αγωγιμότητα.
Η ηλεκτρική αγωγιμότητα οφείλεται στην ελευθερία κίνησης των ηλεκτρονίων και σε αντίθεση με τους ηλεκτρολυτικούς αγωγούς δεν συνεπάγεται χημικές αλλοιώσεις του μετάλλου, ενώ μειώνεται με την αύξηση της θερμοκρασίας. Η ικανότητα απορρόφησης και μεταφοράς εξάλλου θερμικής ενέργειας από τα ελεύθερα ηλεκτρόνια των μετάλλων έχει ως αποτέλεσμα την υψηλή θερμική αγωγιμότητά τους. Η θερμική αγωγιμότητα των μετάλλων εξηγείται από το ότι όταν τα ελεύθερα ηλεκτρόνια βρίσκονται σε θερμές περιοχές, αποκτούν μεγάλη κινητική ενέργεια και έτσι κινούμενα πολύ γρήγορα μέσα στο μέταλλο αποδίδουν την κινητική τους ενέργεια στις ψυχρές περιοχές με την μορφή θερμότητας. Μηχανικές ιδιότητες
Τα μέταλλα
είναι ελατά και όλκιμα και έχουν μεγάλη
ελαστικότητα. Ελατά σημαίνει ότι μπορούν να μεταβάλλονται σε ελάσματα ή φύλλα. Όλκιμα σημαίνει ότι μπορούν να μεταβάλλονται σε σύρματα. Είναι χαρακτηριστικό το γεγονός ότι το κρυσταλλικό πλέγμα των μετάλλων διατηρείται όταν αυτά υποβάλλονται σε μετρίου μεγέθους παραμορφώσεις. Πράγματι, επειδή οι δομικές μονάδες του πλέγματος των μετάλλων είναι θετικά φορτισμένα ιόντα και οι ηλεκτρική ουδετερότητα αποκαθίσταται από το αέριο των ελευθέρων ηλεκτρονίων τα οποία κινούνται οπουδήποτε στο χώρο του μετάλλου, τυχόν μετακινήσεις στο πλέγμα δεν συνεπάγονται εμφάνιση απωστικών δυνάμεων. Χημικές ιδιότητες
Α) Γενικά,
όπως αναφέρθηκε, έχουν μικρή ηλεκτροσυγγένεια,
ηλεκτραρνητικότητα και ενέργεια ιοντισμού. Έχουν, δηλαδή, την τάση να αποδώσουν ηλεκτρόνια και να μετατραπούν σε κατιόντα. Δίνουν λοιπόν, αντιδράσεις συνθέσεως με τα διάφορα αμέταλλα. Τα μέταλλα στις ενώσεις τους εμφανίζονται πάντα με θετικό αριθμό οξειδώσεως.
Τα μέταλλα
παράγουν βασικά οξείδια.
Όπως είδαμε και στο εργαστήριο, στο υδατικό διάλυμα του καλίου (K) δημιουργήθηκαν υδροξείδια καλίου (KOH). Εφόσον, λοιπόν, το διάλυμα έγινε βασικό, ο δείκτης φαινολοφθαλεΐνης έγινε ροζ. Αντίθετα τα αμέταλλα, όπως θα δούμε παρακάτω, δίνουν αρνητικά ιόντα (ανιόντα), χαρακτηρίζονται ηλεκτραρνητικά, και παράγουν ουδέτερα ή όξινα οξείδια.
Β)Αντιδράσεις
συνθέσεως με τα διάφορα αμέταλλα. Στις αντιδράσεις αυτές τα μέταλλα
συμπεριφέρονται ως αναγωγικά, ενώ τα αμέταλλα ως οξειδωτικά. Στις συνηθισμένες
συνθήκες θερμοκρασίας και πίεσης, η επίδραση του ατμοσφαιρικού αέρα σ’ ένα
μέταλλο εξαρτάται από το αν ο αέρας είναι ξερός ή περιέχει υδρατμούς, και από
τη φύση του μετάλλου. Έτσι:
1.
Τα αλκάλια και οι αλκαλικές γαίες όταν μένουν
στον αέρα
γρήγορα ή αργά σχηματίζουν οξείδια, τα οποία με την υγρασία και το CO2 μετατρέπονται μερικά ή ολικά σε υδροξείδια και ανθρακικά άλατα.
2.
Τα μέταλλα ψευδάργυρος, μόλυβδος και χαλκός όταν
μείνουν στον αέρα οξειδώνονται επιφανειακά και καλύπτονται έτσι από ένα στρώμα βασικού ανθρακικού άλατος, που τα προστατεύει από περεταίρω οξείδωση.
3.
Ο σίδηρος όταν αφήνεται στον αέρα καλύπτεται από
καστανέρυθρη σκουριά που όχι μόνο δεν προστατεύει το σίδηρο από περεταίρω οξείδωση αλλά αντίθετα επιταχύνει τη διάδοσή της στο εσωτερικό του (διάβρωση).
4.
Ο άργυρος όταν παραμείνει για πολύ στον αέρα
καλύπτεται
από ένα στρώμα μαύρου θειικού αργύρου που σχηματίζεται με την επίδραση του υδρόθειου της ατμόσφαιρας.
5.
Τα λοιπά μέταλλα όπως ο κασσίτερος, το νικέλιο,
το χρώμιο,
το κοβάλτιο δεν προσβάλλονται όταν παραμείνουν στον αέρα και γι’ αυτό χρησιμοποιούνται για την προστασία άλλων μετάλλων που προσβάλλονται (επιμετάλλωση).
Γ)
Οξειδοαναγωγική ικανότητα. Η οξειδοαναγωγική ικανότητα των
μετάλλων εξαρτάται απ’ την τάση που έχουν να αποδώσουν ηλεκτρόνια και να μετατραπούν σε θετικά ιόντα. Όσο μεγαλύτερη είναι αυτή η τάση για απόδοση ηλεκτρονίων, όσο δηλαδή μεγαλύτερο είναι το δυναμικό οξειδώσεως ενός μετάλλου τόσο μεγαλύτερη θα είναι η αναγωγική του ισχύς. Αντίστροφα, όσο μικρότερο (ή περισσότερο αρνητικό)είναι το δυναμικό οξειδώσεως ενός μετάλλου τόσο μεγαλύτερη θα είναι η οξειδωτική του ισχύς. Η σειρά σύμφωνα με την οποία ελαττώνεται η αναγωγική ισχύς των μετάλλων (επομένως η σειρά με την οποία αυξάνεται η οξειδωτική ισχύς τους) δίνεται από την ηλεκτροχημική σειρά.  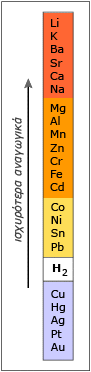 Αμέταλλα
Απ’
τα γνωστά σήμερα στοιχεία, τα 23 χαρακτηρίζονται σαν αμέταλλα.
Περιέχονται στις κύριες ομάδες που βρίσκονται στο τέλος του περιοδικού πίνακα, δηλαδή έχουν αρκετά εξωτερικά ηλεκτρόνια (5-7e-). Επομένως χρειάζονται λίγα ηλεκτρόνια για να συμπληρώσουν τους εξωτερικούς τους υποφλοιούς. Ασκούν ισχυρή έλξη στα εξωτερικά τους ηλεκτρόνια και γι’ αυτό έχουν μεγάλη ενέργεια ιοντισμού, μεγάλη ηλεκτροσυγγένεια και ηλεκτραρνητικότητα. Τα μεγέθη αυτά ελαττώνονται από δεξιά προς τ’ αριστερά στην ίδια περίοδο και από πάνω προς τα κάτω στην ίδια ομάδα του περιοδικού συστήματος. Προέλευση
Τα ευγενή
αέρια βρίσκονται στη φύση μόνο σαν
ελεύθερα στοιχεία. Τα αλογόνα (VII ομάδα), επειδή είναι δραστικά στοιχεία, βρίσκονται στη φύση μόνο ενωμένα. Tα υπόλοιπα αμέταλλα βρίσκονται στη φύση και ενωμένα και ελεύθερα. Φυσικές ιδιότητες
Τα αμέταλλα
είναι στερεά (όπως βόριο, άνθρακας, θείο) και
αέρια (όπως τα ευγενή αέρια και το οξυγόνο, το άζωτο, το υδρογόνο κ.ά.) εξαίρεση αποτελεί το βρόμιο που βρίσκεται σε υγρή κατάσταση.
Επίσης, τα
αμέταλλα είναι κακοί αγωγοί του ηλεκτρισμού.
Είναι δυσδιάλυτα στο νερό και σε άλλα διαλυτικά. Μερικά από αυτά διαλύονται σε οργανικά διαλυτικά. Χημικές ιδιότητες
Γενικά,
όπως αναφέρθηκε χαρακτηριστικό των αμετάλλων είναι
ότι έχουν μεγάλη ηλεκτραρνητικότητα και ηλεκτροσυγγένεια. Έτσι τα αμέταλλα που χρειάζονται ένα με δύο ηλεκτρόνια για τη συμπλήρωση του εξωτερικού φλοιού, όπως τα στοιχεία της 7ης και 6ης ομάδας, εύκολα μετατρέπονται σε αρνητικά ιόντα, παίρνοντας ένα με δύο ηλεκτρόνια κατά τις αντιδράσεις τους με μέταλλα. Από τα αμέταλλα της 5ης ομάδας μόνο το άζωτο εμφανίζεται σαν ιόν Ν3- στις ενώσεις του με πολύ δραστικά μέταλλα. Οι ενώσεις των υπολοίπων αμετάλλων με τα μέταλλα είναι ετεροπολικές.
Στις ενώσεις
τους με τα άλλα αμέταλλα τα άτομά τους συγκρατιούνται με
ομοιοπολικούς δεσμούς. Τα αμέταλλα εμφανίζονται τόσο με θετικό όσο και με αρνητικό αριθμό οξείδωσης, εκτός από το φθόριο που εμφανίζεται πάντα με αριθμό οξείδωσης -1. Αντιδράσεις σύνθεσης
Τα αμέταλλα
δίνουν αντιδράσεις σύνθεσης στις οποίες όταν
αντιδρούν με μέταλλα συμπεριφέρονται σαν οξειδωτικά, ενώ όταν αντιδρούν με άλλα αμέταλλα, τότε το αμέταλλο που έχει το μικρότερο αριθμό οξείδωσης, συμπεριφέρεται σαν οξειδωτικό, και το άλλο αμέταλλο σαν αναγωγικό.
Τα αμέταλλα
αντιδρούν απευθείας με το Ο2 και σχηματίζουν οξείδια,
εκτός από τα αλογόνα πους σχηματίζουν με έμμεσο τρόπο οξείδια και από το Ν2 που αντιδρά σε θερμοκρασίες πάνω από τους 3000⁰C και σε μικρό ποσοστό. Τα κανονικά οξείδια των αμετάλλων χαρακτηρίζονται σαν όξινα οξείδια ή ανυδρίτες οξέων. Οξειδοαναγωγική ικανότητα
Η
Οξειδοαναγωγική ικανότητα δίνεται με βάση τα δυναμικά
οξείδωσης από τον παρακάτω πίνακα. Εφόσον ανεβαίνουμε τη σειρά από το θείο στο φθόριο, έχουμε την αύξηση της τάσης προς αναγωγή, και επομένως αύξηση της οξειδωτικής ισχύος.
Μεταλλοειδή
Τα
χημικά στοιχεία με ιδιότητες ανάμεσα σ’ αυτές των τυπικών μετάλλων και
των αμετάλλων χαρακτηρίζονται ως ημιμέταλλα ή μεταλλοειδή. Συνήθως θεωρούμε ημιμέταλλα τα χημικά στοιχεία βόριο, πυρίτιο, γερμάνιο, αρσενικό, αντιμόνιο και τελλούριο. Τα σπάνια στοιχεία πολώνιο και αστάτιο είναι συμπεριλαμβάνονται κι αυτά πολλές φορές σε αυτή την κατηγορία. Τα περισσότερα από αυτά τα στοιχεία είναι σημαντικά στη βιομηχανία, αφού χρησιμοποιούνται για την παρασκευή κρυσταλλολυχνιών και ημιαγωγών συσκευών, κεραμικών, ηλιακών συλλεκτών και μερικών πολυμερών. Παρακάτω απεικονίζονται δύο γνωστά μεταλλοειδή, το αρσενικό και το πυρίτιο. 
Το πυρίτιο είναι ημιμέταλλο
Τα
μεταλλοειδή είναι συνήθως εύθραυστα, γυαλιστερά στερεά που
συμπεριφέρονται σαν ηλεκτρικοί μονωτές σε θερμοκρασία δωματίου αλλά μοιάζουν με τα μέταλλα σαν αγωγοί ηλεκτρικού ρεύματος όταν θερμαίνονται ή όταν μικρές ποσότητες συγκεκριμένων στοιχείων εισαχθούν στα πλέγματα των κρυσταλλικών τους δομών. Η διαγώνιος με τα πράσινα κουτάκια περιλαμβάνει μεταλλοειδή. 
Τα μεταλλοειδή έχουν ηλεκτρονιακή
δομή ενδιάμεση της σχεδόν κενής εξωτερικής
στοιβάδας των τυπικών μετάλλων και της σχεδόν γεμάτης των αμετάλλων. Επίσης, οι χημικές τους ιδιότητες είναι ενδιάμεσες της συμπεριφοράw των ηλεκτροθετικών και των ηλεκτραρνητικών ατόμων. Βιβλιογραφία
Στοιχεία Ανόργανης Χημείας, Κ. Μανωλκίδη, Κ. Μπέζα, Αθήνα
1978
Γενική Χημεία- 1ο Γενικό Μέρος, Π. Οδ.
Σακελλαρίδη, Αθήνα 1985
Εγκυκλοπαίδεια Μπριτάννικα
Εγκυκλοπαίδεια Πάπυρος- Λαρούς- Μπριτάννικα
|
Δεν υπάρχουν σχόλια:
Δημοσίευση σχολίου